Los métodos alternativos a la experimentación animal han demostrado ser herramientas valiosas para evaluar la seguridad de productos químicos, fármacos y cosméticos. Sin embargo, antes de que puedan ser utilizados con fines regulatorios, deben atravesar un riguroso proceso de validación. Cada paso tiene un objetivo claro en pos de responder a la pregunta: éste método ¿es confiable?
En esta nota, te contamos cómo un método alternativo pasa de ser una idea en el laboratorio a convertirse en un estándar regulatorio.
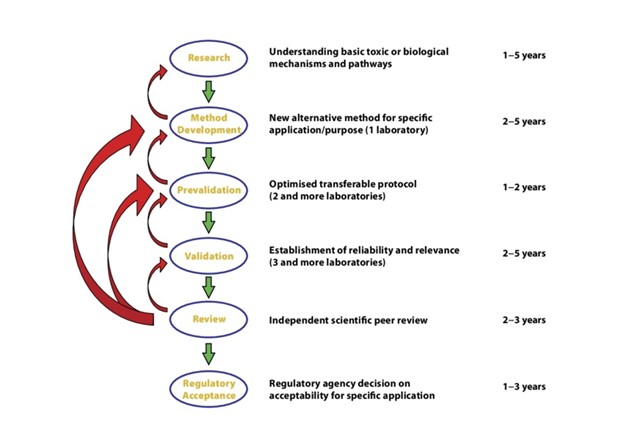
Paso 1: Desarrollo y optimización
Todo comienza en el laboratorio, donde los investigadores diseñan el método y lo ponen a prueba en condiciones controladas. En esta etapa, los objetivos son definir qué medir y diseñar un protocolo confiable que produzca resultados consistentes dentro de un mismo laboratorio.
Se evalúan aspectos como:
¿El modelo responde de manera predecible a sustancias conocidas?
¿El ensayo es capaz de diferenciar entre compuestos tóxicos y no tóxicos?
¿La metodología es clara y puede ser replicada?
Paso 2: Prevalidación
La prevalidación busca evaluar la reproducibilidad y detectar posibles fallas antes de invertir recursos en una validación formal.
En esta fase, el método se prueba en diferentes condiciones y en más de un laboratorio para evaluar:
Reproducibilidad: ¿el mismo laboratorio obtiene resultados similares en distintos días?
Transferibilidad: ¿si otro laboratorio sigue el protocolo, obtiene los mismos resultados?
Robustez: ¿qué tanto afectan factores como la marca de los reactivos, los equipos de medición, el operador, etc. en los resultados obtenidos?
Paso 3: Validación formal
Este es el paso más exigente y el que determinará si el método tiene futuro regulatorio. Instituciones especializadas como ECVAM (Europa), ICCVAM (EE.UU.) y JaCVAM (Japón) organizan estudios en múltiples laboratorios, idealmente ubicados en diferentes continentes, bajo condiciones estandarizadas y estrictos criterios de calidad.
El objetivo principal de esta etapa es demostrar que el método es robusto, preciso y adecuado para su propósito. Se evalúan aspectos como:
Reproducibilidad intra-laboratorio: Identifica la variabilidad que existe si el protocolo es realizado por diferentes personas o en diferentes momentos en un mismo laboratorio.
Reproducibilidad inter-laboratorio: Si se usa el mismo protocolo en diferentes lugares, ¿los resultados siguen siendo los mismos?
Relevancia y exactitud: Las variables a medir ¿son un parámetro representativo de lo que quiero evaluar? ¿El método realmente predice lo que queremos medir? Para comprobarlo, se compara con datos históricos o con métodos tradicionales.
Sensibilidad y especificidad: ¿Detecta correctamente los casos positivos y los negativos? ¿Cuál es la probabilidad de obtener falsos positivos y falsos negativos? Y muy importante ¿cuál es la probabilidad de no lograr identificar un producto tóxico?
Paso 4: Evaluación científica y aceptación regulatoria
Una vez obtenidos los datos de validación, éstos se presentan a un comité de expertos quienes los revisan en detalle. Acá, la pregunta clave es: ¿Este método puede reemplazar las pruebas en animales de manera segura?
Los organismos regulatorios, como la FDA (Administración de Alimentos y Medicamentos de EE.UU.) o la OCDE (Organización para la Cooperación y el Desarrollo Económico) pueden aceptar el método si cumple con los criterios de validación. Analizan aspectos como:
¿El método es aplicable a diferentes sustancias o tiene limitaciones?
¿Sustituye completamente la prueba en animales o debe usarse en combinación con otros métodos?
¿Es práctico y viable para ser implementado a gran escala?
Si el método cumple con todos los requisitos, se emiten recomendaciones y puede ser incluido en normativas internacionales como las Guías de Ensayo de la OCDE, lo que facilita su aceptación global.
Paso 5: Implementación y monitoreo
La aprobación no significa el final del camino. Ahora viene el desafío de la implementación:
Capacitación: Los laboratorios deben aprender a usar el nuevo método correctamente.
Adaptación de regulaciones: La industria debe ajustar sus protocolos para incluir el nuevo enfoque.
Monitoreo del desempeño: Se analiza si el método sigue funcionando bien en la práctica y si es necesario hacer ajustes.
A veces, tras la implementación, se descubren mejoras que pueden optimizar el método aún más. Este proceso de retroalimentación es fundamental para su éxito a largo plazo.
Si bien la validación de un método alternativo puede tardar varios años, es crucial para garantizar que sea confiable y aceptado globalmente. Cada método aprobado representa un avance hacia una ciencia más ética y precisa, reduciendo la dependencia de los ensayos en animales sin comprometer la seguridad.
Fuentes
Griesinger C, Desprez B, Coecke S, Casey W, Zuang V. Validation of Alternative In Vitro Methods to Animal Testing: Concepts, Challenges, Processes and Tools. Adv Exp Med Biol. 2016;856:65-132. doi: 10.1007/978-3-319-33826-2_4. PMID: 27671720.
OCDE Guide Number 34: GUIDANCE DOCUMENT ON THE VALIDATION AND INTERNATIONAL ACCEPTANCE OF NEW OR UPDATED TEST METHODS FOR HAZARD ASSESSMENT


