La Farmacopea Europea y la de Estados Unidos asumen un compromiso histórico en pos del reemplazo de las pruebas de pirógenos y endotoxinas realizadas en animales respectivamente.
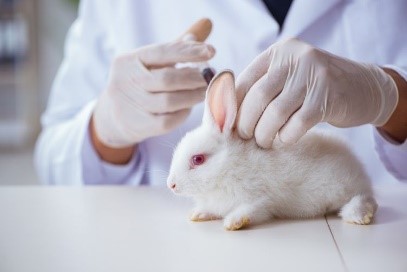
La prueba de pirógenos en conejos (RPT) ha sido el método tradicional para la detección de pirógenos en productos inyectables e implantables. Recientemente la Farmacopea Europea, organización responsable de establecer los estándares de seguridad en la fabricación de productos médicos, ha confirmado que esta prueba será eliminada de sus textos. Esta decisión histórica se tomó durante la 179.ª sesión de la Farmacopea Europea en junio de 2024.
En 2021, la Comisión de la Farmacopea Europea (EPC) se comprometió a sustituir por completo la RPT en sus 59 textos por una alternativa in vitro adecuada. Finalmente, este año, el CPE adoptó 57 textos revisados, en los cuales el RPT no está presente y no será exigido su uso. En su lugar, los desarrolladores de medicamentos tendrán que seleccionar una prueba in vitro, como la prueba de activación de monocitos, que sea adecuada para controlar la pirogenicidad de los productos. Dicha elección puede realizarse en función de una evaluación de riesgos incluida en el nuevo capítulo sobre pirogenicidad.
La EPC destacó que está “comprometida” a reducir el uso de animales “siempre que sea posible en las pruebas exigidas por farmacopea, basándose en el Convenio Europeo para la Protección de los Animales Vertebrados Utilizados para Experimentación y otros Fines Científicos (ETS No. 123).
Los textos revisados y el nuevo capítulo sobre pirogenicidad se publicarán en el Suplemento 11.8 de la Farmacopea Europea. La fecha de implementación es el 1 de julio de 2025.
En alineamiento con Europa, la Farmacopea de Estados Unidos (USP) ha implementado un cambio regulatorio que permite el uso de métodos alternativos a los cangrejos herradura, cuya sangre se utiliza para probar la seguridad en el ensayo LAL (Limulus Amebocyte Lysate) debido a su capacidad para detectar endotoxinas en inyectables, incluidos medicamentos y vacunas.
Durante años, el Comité de Médicos por una Medicina Responsable (PCRM, por sus siglas en inglés) ha abogado por este cambio de política, realizando mesas redondas, talleres y sesiones de capacitación, contribuyendo a la literatura científica y colaborando con líderes del Congreso para la adopción de métodos de prueba sin animales.
La acción de la USP de hoy reconoce los enfoques sin animales como opciones seguras y equivalentes. Con este cambio, las empresas pueden elegir con confianza opciones sin animales para las pruebas de endotoxinas.
Los métodos alternativos, conocidos colectivamente como pruebas de endotoxinas bacterianas recombinantes (rBET), no solo no utilizan animales, sino que también ofrecen mayor confiabilidad y consistencia. Las versiones sintéticas permiten a los científicos evitar los falsos positivos asociados con las pruebas de endotoxinas basadas en sangre y ayudan a garantizar una cadena de suministro estable al evitar la dependencia de la sangre de animales salvajes que están sujetos a presiones ambientales.
La FDA ya ha aceptado los métodos rBET para varios productos comercializados, después de que Eli Lilly, líder en el avance de la ciencia y la aceptación de la rBET, trabajara con la agencia caso por caso.
Si bien este logro es un gran paso adelante, el Comité de Médicos sigue dedicado a los esfuerzos en curso para eliminar todos los usos de cangrejos herradura en las pruebas de endotoxinas.
La adopción de métodos alternativos tanto para la detección de pirógenos como de endotoxinas, sin duda, conllevará a un impacto significativo en la sustitución, reducción y refinamiento de las pruebas con animales en el control de calidad de los medicamentos.
Fuentes:


Excelente!
hola hola hola
Hurray, this is just the right information that I needed. You make me want to learn more! Stop by my page Webemail24 about PR Marketing.
Can you be more specific about the content of your article? After reading it, I still have some doubts. Hope you can help me.